El Principio de Exclusión de Pauli // Pauli's Exclusion Principle
Hello dear hive community! 😉
¡Hola querida comunidad de hive! 😉
En reiteradas publicaciones, sobre todo hablando acerca de las partículas elementales se describió por encima lo que era el Principio de Exclusión de Pauli, Pero en esta ocasión quiero compartir con ustedes más a profundidad de ese tema.
In several publications, especially talking about elementary particles, the Pauli Exclusion Principle was described above, but this time I want to share with you more in depth about this topic.

Imagen realizada con la página web de diseño gráfico y composición de imágenes Canva // Image made with the graphic design and image composition website Canva.
Antes de comenzar a hablar sobre dicho principio, es importante conocer sobre Wolfgang Ernst Pauli quien fue un físico teórico de origen austriaco con nacionalidad estadounidense, se le conoce como uno de los padres de la mecánica cuántica, por el principio de Exclusión que lleva su nombre. Cabe destacar que Albert Einstein lo nominó al Premio Nobel de Física en 1945, el cual ganó gracias a su valioso aporte sobre el descubrimiento de una nueva ley de la naturaleza, el principio de exclusión o Principio de Pauli.
Before starting to talk about this principle, it is important to know about Wolfgang Ernst Pauli who was a theoretical physicist of Austrian origin with American nationality, he is known as one of the fathers of quantum mechanics, for the Exclusion Principle that bears his name. Albert Einstein nominated him for the Nobel Prize in Physics in 1945, which he won thanks to his valuable contribution to the discovery of a new law of nature, the Exclusion Principle or Pauli Principle.
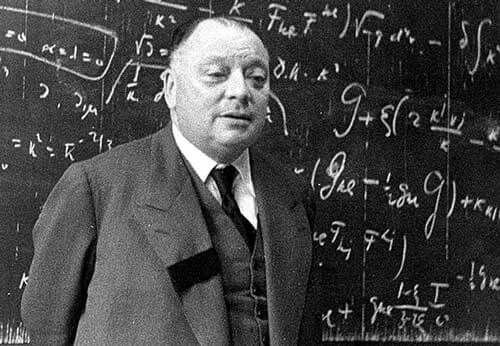
Source
Cómo seres humanos habitantes de este impresionante universo, creo que nunca nos hemos preguntado cómo se mantiene tan ordenado, observamos que se mueve tan perfectamente y aunque por ejemplo yo creo en un ser superior que lo pudo haber creado no hay manera de saber cómo funciona tan perfectamente. Pero resulta, que la ciencia sí ha podido dar respuesta a algunas de las cosas que en ocasiones nos preguntamos. Fácilmente visualizamos un sistema súper ordenado, un sistema solar donde los planetas giran en sus respectivas órbitas, por otra parte los átomos forman moléculas y esas moléculas construyen absolutamente todo lo que conocemos en este mundo. Ahora, si hacemos un análisis más de cerca a una escala extremadamente pequeña, la realidad es que el universo se encuentra inmerso en un mundo lleno de caos, es la naturaleza microscópica, dónde los protagonistas principales son los átomos y las partículas subatómicas, las leyes son muy distintas a las que conocemos en la cotidianidad.
Una de dichas leyes es el Principio de Exclusión de Pauli, una teoría relativamente nueva que explica por qué la materia tiene estructura y porque él universo existe. Este principio que fue formulado en 1925, establece que “dos electrones no pueden ocupar el mismo estado cuántico dentro de un sistema”. En conclusión, dos electrones no pueden estar en un mismo lugar si comparten todas las características cuánticas pero, ¿qué tan relevante es eso?
As human beings, inhabitants of this impressive universe, I think we have never wondered how it is kept so orderly, we observe that it moves so perfectly and although I believe in a superior being that could have created it, there is no way to know how it works so perfectly. But it turns out that science has been able to answer some of the questions we sometimes ask ourselves. We easily visualize a super-ordered system, a solar system where the planets rotate in their respective orbits, on the other hand the atoms form molecules and those molecules build absolutely everything we know in this world. Now, if we make a closer analysis at an extremely small scale, the reality is that the universe is immersed in a world full of chaos, it is the microscopic nature, where the main protagonists are atoms and subatomic particles, the laws are very different from those we know in everyday life.
One such law is the Pauli Exclusion Principle, a relatively new theory that explains why matter has structure and why the universe exists. This principle, which was formulated in 1925, states that “two electrons cannot occupy the same quantum state within a system”. In conclusion, two electrons cannot be in the same place if they share all quantum characteristics, but how relevant is that?
Source
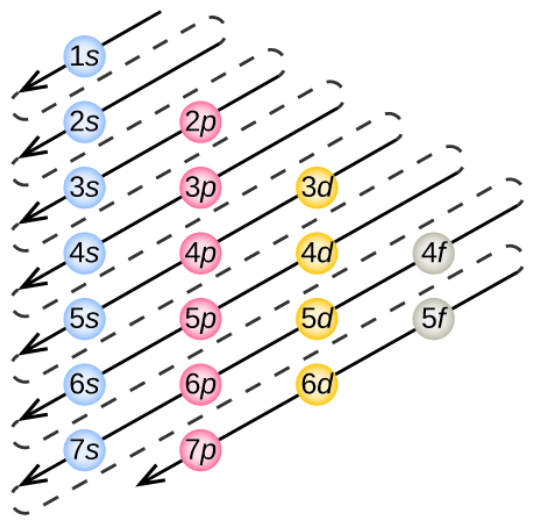
Para darle respuesta a esa pregunta, es importante conocer con exactitud de qué trata el Principio de Exclusión. Los átomos son algo así como los bloques de construcción de todo lo que conocemos, sabemos que el núcleo atómico hay protones y neutrones, a su vez alrededor del núcleo están los electrones, los cuales son partículas subatómicas muy pequeñas y ligeras que están orbitando en diferentes regiones conocidas como niveles de energía. Esas órbitas no son como las trayectorias de los planetas; pues en el mundo cuántico, los electrones no poseen una posición fija, sino que están en algo así como una nube probabilística.
Resulta que cada electrón en un átomo está definido por un conjunto de propiedades llamadas números cuánticos, los cuales describen su comportamiento y su posición dentro del átomo. Las propiedades incluyen:
Energía principal: que es la capa o nivel del electrón.
Momento angular: describe el tipo de movimiento del electrón dentro de ese nivel.
Orientación: el cual señala la dirección específica del movimiento.
El spin: se trata de una propiedad intrínseca que, de manera simplificada, puede imaginarse como un giro del electrón, cuya orientación puede ser hacia arriba o hacia abajo.
To answer this question, it is important to know exactly what the Exclusion Principle is all about. Atoms are something like the building blocks of everything we know, we know that in the atomic nucleus there are protons and neutrons, and around the nucleus there are electrons, which are very small and light subatomic particles that are orbiting in different regions known as energy levels. These orbits are not like the trajectories of the planets; for in the quantum world, the electrons do not have a fixed position, but are in something like a probabilistic cloud.
It turns out that each electron in an atom is defined by a set of properties called quantum numbers, which describe its behavior and its position within the atom. The properties include:
Principal energy: which is the electron's shell or level.
Angular momentum: describes the type of motion of the electron within that level.
Orientation: which points to the specific direction of motion.
Spin: this is an intrinsic property that, in a simplified way, can be imagined as a spin of the electron, whose orientation can be up or down.

Source
Todas estas características ya descritas forman algo así como una huella digital única para cada electrón. Ahora bien, el Principio de Exclusión de Pauli establece que dos electrones no pueden presentar exactamente el mismo conjunto de números cuánticos en un átomo. No obstante, si un electrón ya presenta un estado particular, otro debe buscar un estado diferente; es decir, si dos electrones están en el mismo nivel de energía, en la misma órbita y poseen la misma orientación, obligatoriamente tendrán spins opuestos.
Ahora bien, esta regla es de suma importancia ya que es la razón de que los átomos presenten una estructura y, por ende, que la materia sea tal cual como es. Si el Principio de Exclusión no existiera los electrones podrían concentrarse todos en el nivel de energía más bajo colapsando el núcleo; esto haría que todos los átomos fueran iguales, sin capas y niveles, por lo que no habría diferencia de elementos químicos.
El Principio de Exclusión de Pauli, hace que los electrones se distribuyen en niveles y subniveles específicos. Un ejemplo muy popular es el átomo de hidrógeno, el cual tiene un solo electrón en su nivel más bajo, mientras que el de helio tiene dos electrones, se colocan en el mismo nivel pero con spins opuestos.
All these characteristics described above form something like a unique fingerprint for each electron. Now, the Pauli Exclusion Principle states that two electrons cannot have exactly the same set of quantum numbers in an atom. However, if one electron already has a particular state, another must seek a different state; that is, if two electrons are in the same energy level, in the same orbital and have the same orientation, they will necessarily have opposite spins.
Now, this rule is of utmost importance since it is the reason why atoms present a structure and, therefore, why matter is as it is. If the Exclusion Principle did not exist the electrons could all concentrate in the lowest energy level collapsing the nucleus; this would make all atoms equal, without layers and levels, so there would be no difference in chemical elements.
The Pauli Exclusion Principle means that electrons are distributed in specific levels and sublevels. A very popular example is the hydrogen atom, which has only one electron in its lowest level, while the helium atom has two electrons, placed in the same level but with opposite spins.
Ya para despedirme espero que el tema sea del agrado de los lectores y deseo ver en los comentarios sus opiniones y aportes significativos que ayuden a la ampliación del tema y que genere un debate crítico y enriquecedor para la satisfactoria divulgación del conocimiento científico
In closing, I hope that the topic is to the readers' liking and I hope to see in the comments your opinions and significant contributions that will help to broaden the topic and generate a critical and enriching debate for the satisfactory dissemination of scientific knowledge.
Referencias
GIANCOLI, DOUGLAS. (2007). Física. Editorial: Pearson
Serway, R; Jewett J. (2005). Física para Ciencias e Ingeniería. Editorial Thomson: México.
Zemansky, S. (2009). Física Universitaria Volumen II. México: Pearson Educación.
References
GIANCOLI, DOUGLAS. (2007). Physics. Publisher: Pearson
Serway, R; Jewett J. (2005). Physics for Science and Engineering. Editorial Thomson: México.
Zemansky, S. (2009). Physics Volume II. Mexico: Pearson Educación.
Translator Deepl


Posted Using INLEO
https://x.com/ILovePhysica/status/1946016475988336688?t=WIASUZatoEZKDFgvqDhutg&s=19
Thanks for your contribution to the STEMsocial community. Feel free to join us on discord to get to know the rest of us!
Please consider delegating to the @stemsocial account (85% of the curation rewards are returned).
Consider setting @stemsocial as a beneficiary of this post's rewards if you would like to support the community and contribute to its mission of promoting science and education on Hive.